

定義1:
$1\,$$\text{A}$ の電流が流れる導体の2点間において消費される電力が $1\,$$\text{W}$ であるときの,その2点間の電圧($\text{W/A}$)
定義2:
導体の2点間を $1\,\text{C}$ の電荷を運ぶのに $1\,$$\text{J}$ の仕事が必要となるときの,その2点間の電圧($\text{J/C}$)
SI基本単位による表記:
$\text{m}^2\cdot\text{kg}\cdot\text{s}^{-3}\cdot\text{A}^{-1}$
-
アレッサンドロ・ボルタ
-
電圧の単位ボルトは,イタリアの物理学者アレッサンドロ・ボルタ(1745年〜1827年)の名前からつけられました。
ボルタは,1799年に発明した電池『ボルタの電堆』で知られる科学者です。

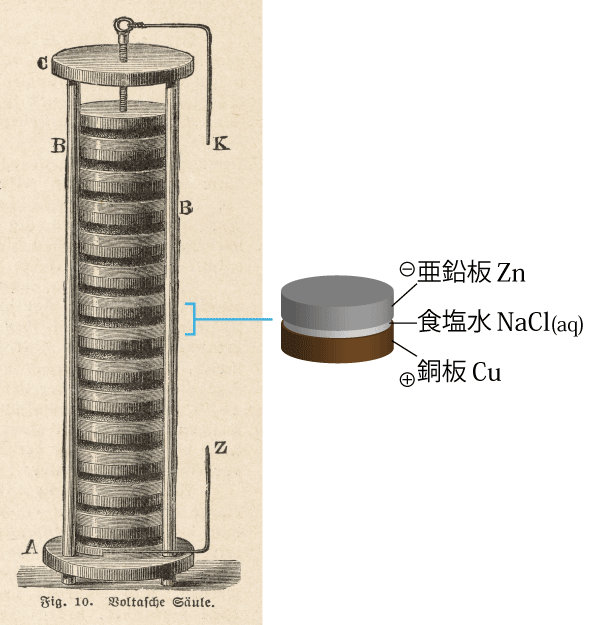
 ボルタの電堆というのは,2種類の金属(亜鉛と銅など)の板の間に食塩水を浸した布や紙をはさんだだけの簡単な構造の電池です。
ボルタの電堆というのは,2種類の金属(亜鉛と銅など)の板の間に食塩水を浸した布や紙をはさんだだけの簡単な構造の電池です。
ボルタの電堆は,大きな電流を安定して取り出すことができる初めての装置で,電気の研究を大きく発展させました。また,電池を積み上げると高い電圧を得ることができたので,化学の分野でも電気分解による元素の発見をもたらしました。
-
1 V ってどのくらい?
-
銅と亜鉛でつくった ダニエル電池 の起電力が,およそ 1 V です。
ダニエル電池は,1836年にイギリスの化学者ジョン・フレデリック・ダニエルによって発明された電池です。−極(負極)側に硫酸亜鉛水溶液に浸した亜鉛板,+極(正極)側に硫酸銅(Ⅱ)水溶液に浸した銅板を用いて,それぞれを素焼き板で仕切ったつくりの電池です。
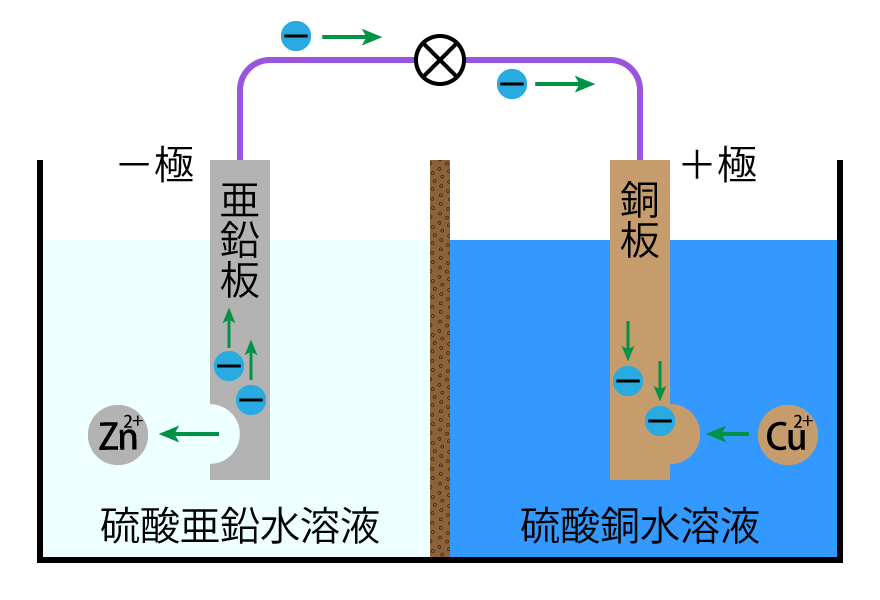
−極では,亜鉛 Zn が電子を放出し,亜鉛イオン Zn$^{2+}$ となって溶け出します。+極では,銅イオン Cu$^{2+}$ が 電子を受け取り,銅 Cu となって析出します。$$\text{−極:}\text{Zn} \, \longrightarrow \text{Zn}^{2+} \, + \, 2\text{e}^−$$電池の起電力は,標準電極電位 という値を使って求められます。$$\text{+極:}\text{Cu}^{2+} \, + \, 2\text{e}^- \, \longrightarrow \text{Cu}$$
亜鉛の標準電極電位は −0.76 V,銅の標準電極電位は +0.34 V なので,この電池の起電力 $V$ は,次のように求まります。このダニエル電池は,新学習指導要領が実施される2021年から中学校3年の理科で学習することになっています。$$ \begin{align} V &= + 0.34 \,\text{V} \, - ( - 0.76 \,\text{V} )\\ &= 1.10 \,\text{V}\\ \end{align} $$
なお,銅と亜鉛でつくったボルタ電池(2018年5月7日現在,中学校3年の理科で学習する電池)の場合は,−極の反応はダニエル電池と同じですが,+極では水素イオンが電子を受け取るため,起電力は 0.76 V になります。


