-
モル濃度って何のこと?
-
単位体積(1 m$^3$,1 cm$^3$など)の溶液に含まれる溶質の物質量(mol数)を,モル濃度といいます。SIの基本単位から組み立てるとmol/m$^3$になりますが,mol/Lがよく使われます。
中学校の理科では扱いませんが,溶液の反応を考えるときには便利な単位なので,高校以降の理科ではとてもよく使われます。
-
質量パーセント濃度と溶液の化学変化
-
溶液の濃度を表すとき,中学校1年の理科では質量パーセント濃度を使いました。
$$ \begin{align} \text{質量パーセント濃度〔%〕} = \frac{\text{溶質の質量〔g〕}}{\text{溶液の質量〔g〕}}\\ \end{align} $$質量パーセント濃度は,溶けているものが同じ水溶液の濃さを比べるときには便利でした。
例えば,砂糖 30 g を水 70 g に溶かした砂糖水aと,砂糖 25 g を水 55 g に溶かした砂糖水bではどちらが濃いか,というような場合です。

溶液の質量は,溶媒(ここでは水)と溶質(ここでは砂糖)の和で求められますから,それぞれの砂糖水の質量パーセント濃度は,次のようになります。
$$ \begin{align} \text{砂糖水a} &: \frac{\text{30 g}}{\text{30 g + 70 g}} = 30 \text{%}\\ \text{砂糖水b} &: \frac{\text{25 g}}{\text{25 g + 55 g}} = 31.25 \text{%}\\ \end{align} $$濃いのは,砂糖水bの方でした。
しかし,この質量パーセント濃度は,溶液の化学変化を扱うときにはあまり便利とはいえません。
例えば,中学校3年の理科で学習する酸とアルカリの中和で考えてみましょう。
【例題】10% の塩酸 10 mL に 10% の水酸化ナトリウム水溶液を少しずつ加えて中性にする実験を考えます。何 mL の水酸化ナトリウム水溶液を加えると,中性になるでしょうか。
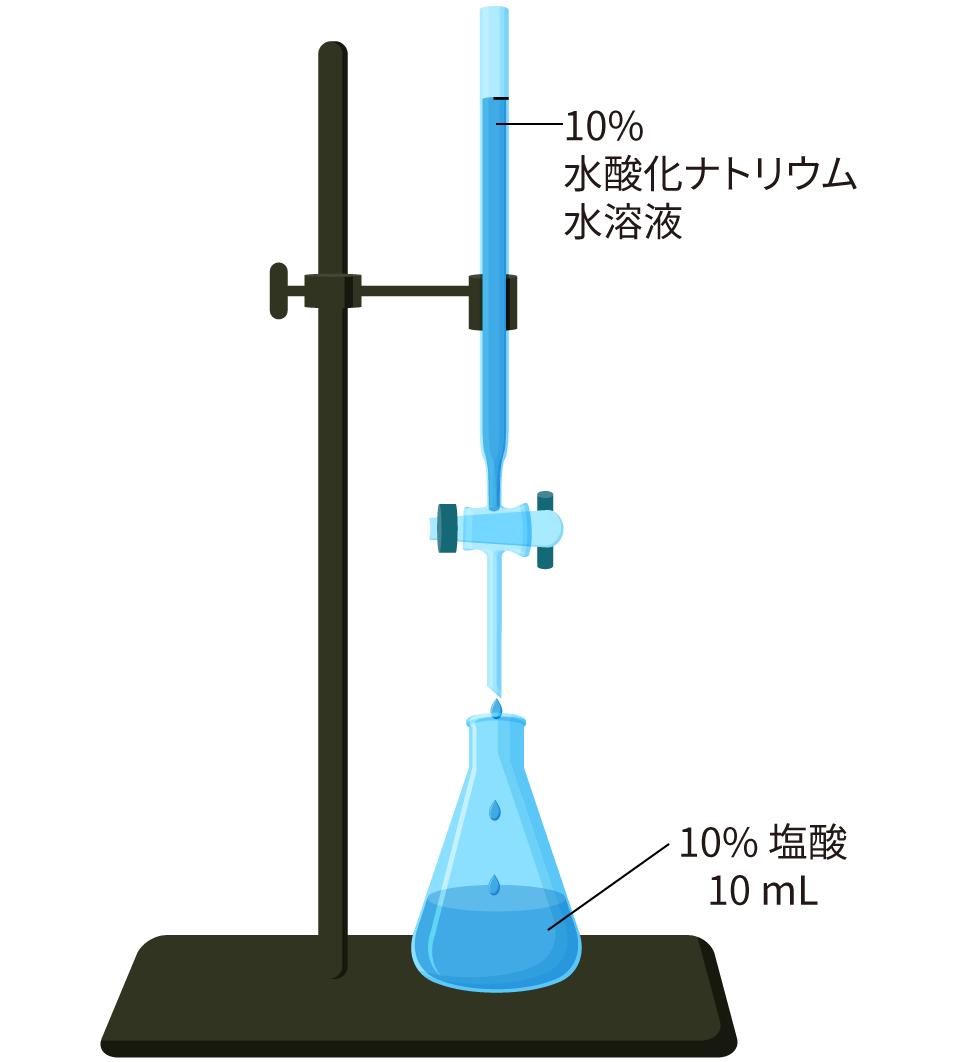
10% の塩酸 10 mL を中和するのに必要な 10% の水酸化ナトリウム水溶液は,どちらも同じ濃度だから 10 mL! と考えるのは早合点です。
この化学変化を化学反応式で表してみましょう。
$$ \begin{align} \ce{HCl + NaOH -> NaCl + H2O}\\ \end{align} $$化学反応式の係数から,HCl 1つに対して NaOH が1つ反応することがわかります。
まず,それぞれの化合物の質量の比を求めてみましょう。質量の比は,原子量(周期表で元素記号の下に書かれています)から求めます。
原子量は,H=1,O=16,Na=23,Cl=35 なので,HCl は 1+35=36,NaOH は 23+16+1=40 となります。
つまり,HCl 36 g を中和するには NaOH 40 g が必要ということです。
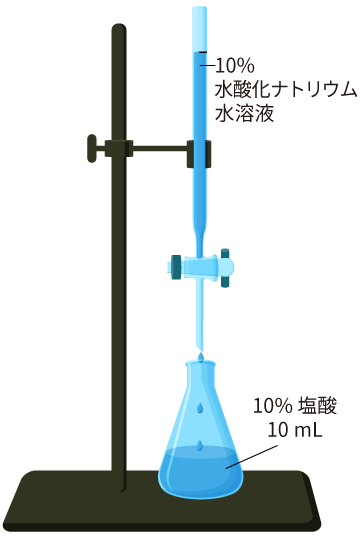
さて,10% の塩酸 10 mL に含まれる HCl の質量を求めるには,この塩酸の密度が必要です。理科年表2020によると,20 ℃ における 10% の塩酸の密度 $\rho_{\text{HCl}}$ は 1.0474 g/cm$^3$ です。
よって,10% の塩酸 10 mL(= 10 cm$^3$) に含まれる HCl の質量 $m_{\text{HCl}}$ は,次のようになります。
$$ \begin{align} m_{\text{HCl}} &= V_{\text{HCl}} \times \rho_{\text{HCl}} \times 10 \text{%}\\ &= 10 \,\text{cm}^3 \times 1.0474 \,\text{g/cm}^3 \times 10 \text{%}\\ &= 10 \times 1.0474 \times 0.1 \,\text{g}\\ &= 1.0474 \,\text{g}\\ \end{align} $$先ほど求めた質量の比から,質量 $m_{\text{HCl}}$ の HCl を中和するのに必要な NaOH の質量 $m_{\text{NaOH}}$ は,$m_{\text{HCl}} \times \frac{40}{36}$ とわかります。
10% の水酸化ナトリウム水溶液の密度 $\rho_{\text{NaOH}}$ は 1.1089 g/cm$^3$ なので,求める体積 $V_{\text{NaOH}}$ は,次のようになります。
$$ \begin{align} V_{\text{NaOH}} &= \frac{ m_{\text{NaOH}} }{ \rho_{\text{NaOH}} } \div 10 \text{%}\\ &= \frac{ m_{\text{HCl}} \times \frac{40}{36} }{ \rho_{\text{NaOH}} } \div 10 \text{%}\\ &= \frac{1.0474 \,\text{g} \times \frac{40}{36}}{1.1089 \,\text{g/cm}^3 \times 0.1}\\ &= 10.4948… \,\text{cm}^3\\ \end{align} $$およそ 10.5 mL です。
…早合点といっていたけれど,だいたい 10 mL じゃないか,と思いましたか?
では,10% の水酸化ナトリウム水溶液のかわりに,10% のアンモニア水だったらどうなるか求めてみましょう。
まずは化学反応式です。
$$ \begin{align} \ce{HCl + NH3 -> NH4Cl}\\ \end{align} $$原子量は,H=1,N=14,Cl=35なので,HCl 36 g を中和するのに必要な NH$_3$ は 17 g です。
10% のアンモニア水の密度 $\rho_{\ce{NH3}}$ は 0.9575 g/cm$^3$ なので,求める体積 $V_{\ce{NH3}}$ は,次のようになります。
$$ \begin{align} V_{\ce{NH3}} &= \frac{ m_{\ce{NH3}} }{ \rho_{\ce{NH3}} } \div 10 \text{%}\\ &= \frac{m_{\text{HCl}} \times \frac{17}{36}}{ \rho_{\ce{NH3}} } \div 10 \text{%}\\\\ &= \frac{1.0474 \,\text{g} \times \frac{17}{36}}{ 0.9575 \,\text{g/cm}^3 \times 0.1 }\\ &= 5.1655… \,\text{cm}^3\\ \end{align} $$約 5.2 mL です。
溶液の化学変化を考えるとき,質量パーセント濃度が揃っていても計算は煩雑なのがわかりますね。
-
モル濃度と溶液の化学変化
-
先ほどの中和で,溶液をモル濃度で調製しておくとどうでしょうか。
0.1 mol/L の塩酸 10 mL を 0.1 mol/L の水酸化ナトリウム水溶液で中和するには,何 mL 必要か考えてみましょう。
化学反応式は,さきほどと同じです。
$$ \begin{align} \ce{HCl + NaOH -> NaCl + H2O}\\ \end{align} $$mol 数というのは,物質のアボガドロ定数(=約 $6.0 \times 10^{23}$) 個の集まりのことで,1 mol の物質の質量が原子量 g(分子量 g,式量 g)になります。
化学反応式の係数から,HCl 1 mol に対して NaOH が 1 mol 反応するとわかります。
0.1 mol/L の塩酸 10 mL に含まれる HCl の mol数は,0.1 $\times \frac{10}{1000}$ mol,これと等しい NaOH が必要なので,求める体積 $V$ は,次のようになります。
$$ \begin{align} \text{HClの mol数} &= \text{NaOHの mol数}\\ 0.1 \,\text{mol/L} \times \frac{10 \,\text{mL}}{1000 \,\text{mL/L}} &= 0.1 \,\text{mol/L} \times V\\ V &= \frac{10}{1000} \,\text{L}\\ &= 10 \,\text{mL}\\ \end{align} $$今度はぴたりと一致します。
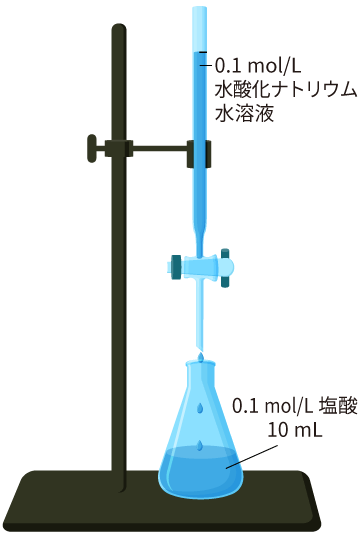
このように,モル濃度を使うと化学変化に必要な溶液の量を求める作業がとても簡単になるのです。
中和の実験をする上でも,加える溶液の「質量」を測るのは難しいですが,「体積」なら目盛りを読むだけでわかりますしね。
-
1 mol/L ってどのくらい?
-
台所で 1 mol/L の水溶液を探してみました。

醤油の食塩(=塩化ナトリウム)濃度はどうでしょうか。

ラベルには,大さじ1杯(15.0 mL)あたりの食塩相当量が 2.5 g とあります。
食塩相当量というのは,ナトリウムの量から計算して求めた食塩の量という意味です。
原子量 Na=23,Cl=35 より,NaCl の式量は58なので,質量 2.5 g の食塩は $2.5 \div 58$ mol です。よって,モル濃度 $c$ は,次のように求められます。
$$ \begin{align} c &= \frac{2.5 \,\text{g} \div 58 \,\text{g/mol}}{15.0 \times 10^{-3}\,\text{L}} \\ &= 2.873... \,\text{mol/L}\\ \end{align} $$…濃いですね。
減塩醤油,っていうのもありますね。

こちらは,大さじ1杯(15.0 mL)あたり 1.4 g とあります。
醤油と同じようにして,モル濃度 $c$ を求めてみましょう。
$$ \begin{align} c &= \frac{1.4 \,\text{g} \div 58 \,\text{g/mol}}{15.0 \times 10^{-3}\,\text{L}} \\ &= 1.609... \,\text{mol/L}\\ \end{align} $$…まだ濃いですね。


お酢の酢酸濃度はどうでしょうか。

ラベルには,酸度 4.2 % とあります。
酸度というのは,100 mL あたりの酸の質量を % で表したものです。お酢に含まれる酸は酢酸 CH$_3$COOH なので,このお酢には 100 mL あたり 4.2 g の酢酸が入っているということになります。
原子量 H=1,C=12,O=16より,CH$_3$COOH の分子量は60なので,4.2 g の酢酸は $4.2 \div 60$ mol です。よって,モル濃度 $c$ は,次のように求められます。
$$ \begin{align} c &= \frac{4.2 \,\text{g} \div 60 \,\text{g/mol}}{100 \times 10^{-3}\,\text{L}} \\ &= 0.7 \,\text{mol/L}\\ \end{align} $$…これも 1 mol/L とは言い難いですね。
みりんのアルコール濃度はどうでしょうか。

ラベルには,アルコール分が13.5度以上14.5度未満とあります。
アルコール度数というのは,100 mL あたりのエタノール C$_2$H$_5$OH の mL の値のことです。
ここでは,100 mL 中に 14 mL のエタノールが含まれていると考えて計算します。
原子量 H=1,C=12,O=16より,C$_2$H$_5$OHの分子量は46です。また,エタノールの密度 $\rho$ は,理科年表2020によると 20 ℃ のとき 0.789 g/cm$^3$ です。
よって,モル濃度 $c$ は,次のように求められます。
$$ \begin{align} c &= \frac{14 \,\text{mL}}{100 \,\text{mL}}\\ &= \frac{14 \,\text{cm}^3 \times 0.789 \,\text{g/cm}^3 \div 46 \,\text{g/mol}}{(100 \times 10^{-3}) \,\text{L}}\\ &= 2.401... \,\text{mol/L}\\ \end{align} $$…濃いですね。

それなら,アルコール度数が 6度くらいだと,エタノールの濃度が 1 mol/L になりそうですね。
探してみました。

つい先日(2019年10月29日)発売開始になった季節限定のビール,サッポロ「冬物語」のアルコール度数が 6 % です。
モル濃度 $c$ は,次のようになります。
$$ \begin{align} c &= \frac{6 \,\text{cm}^3 \times 0.789 \,\text{g/cm}^3 \div 46 \,\text{g/mol}}{(100 \times 10^{-3}) \,\text{L}}\\ &= 1.029... \,\text{mol/L}\\ \end{align} $$




