

定義:
水素イオン濃度 [H$^+$] の常用対数にマイナスをかけたもの
$\text{pH} = -\log \, [\text{H}^+]$
※正確には,水素イオンの活量 $a_{\text{H}^+}$ の逆数の常用対数
$\text{pH} = -\log a_{\text{H}^+}$
-
水素イオン指数って何のこと?
-
水素イオン指数というのは,溶液の酸性・アルカリ性の度合いを示す物理量です。
定義の式にある log を対数(常用対数)といい,指数との間に次のような関係があります。
$$ \begin{align} 10^p = M \qquad \Longleftrightarrow \qquad p = \log M\\ \end{align} $$pHと水素イオン濃度[$\ce{H+}$]の関係にこれを当てはめると,次のようになります。
$$ \begin{align} 10^{-\text{pH}} = \, [\text{H}^+] \qquad \Longleftrightarrow \qquad \text{pH} = -\log \, [\text{H}^+] \\ \end{align} $$水素イオン濃度[$\ce{H+}$]を10の累乗の形で表したときの指数部分にマイナスをつけたのが pH です。
-
pHって何の略?
-
小文字のpに大文字のH。10$^{-12}$ を表す接頭語 pico が,インダクタンスの単位 H(ヘンリー)についているとも読めますが,ここで扱うのは水素イオン指数のpHです。
中学校理科の教科書ではピーエイチという読みが示されていますが,日常ではドイツ語読みの「ペーハー」を耳にすることが多いかもしれません。
pHのHは水素 hydrogen の元素記号です。ですが,pが何の略なのか正確にはわかりません。
pHは,デンマークの化学者セーレン・セーレンセン(1868年〜1939年)によって考案されました。
 Polytech Photos. Scientific photodatabase
Polytech Photos. Scientific photodatabaseセーレンセンは,タンパク質の研究をするなかで,水素イオンの濃度が重要な役割を果たしていることに気づきました。
当時,酸性・アルカリ性の程度を示すのは指示薬の色の変化だけで,酸性・アルカリ性の度合いを数字で表すという概念がなかったため,彼は水素イオン濃度の対数にマイナスをかけたものによるスケールを提案しました。
彼は,この数字を水素イオン指数 hydrogen ion exponent と呼び,記号 p$_{\text{H}^+}$ と記しましたが,この p が何の略なのかは述べませんでした。
そのため,この p には power(力,能力),potential(潜在能力,電位),positive(陽,プラス),といった説があります。
ところで,当時セーレンセンが所属していたのはカールスバーグ研究所といいます。ビールメーカーの研究所です。
 Polytech Photos. Scientific photodatabase
Polytech Photos. Scientific photodatabase
-
どうして7が中性なの?
-
中学校理科では,pH が7のとき中性で,値が小さいほど酸性が強く,値が大きいほどアルカリ性が強いことを学習しました。
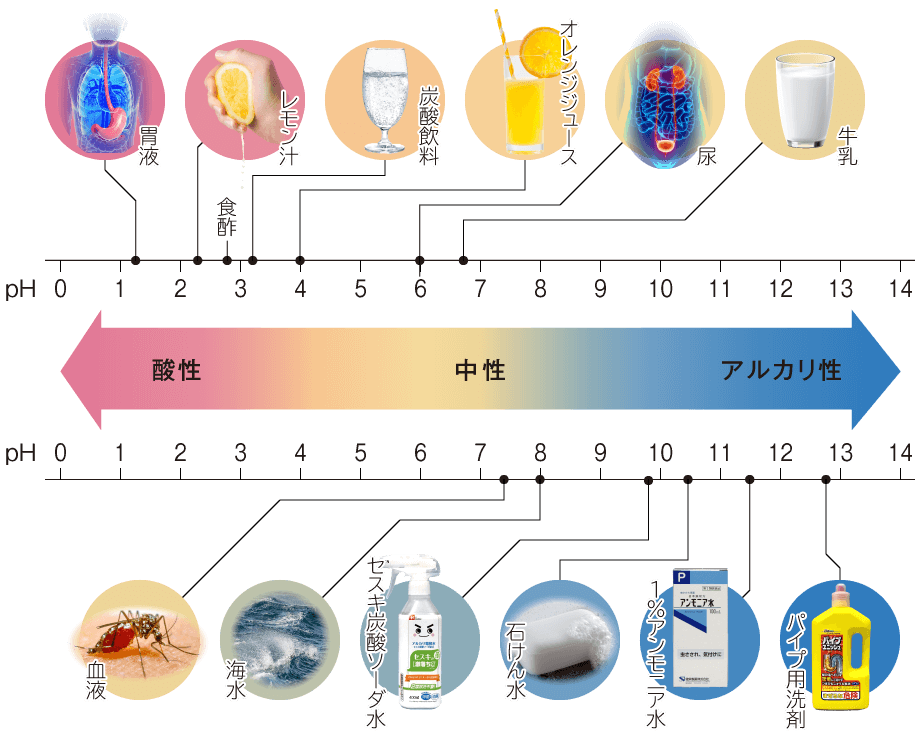
中性の「7」はどこから来たのでしょうか。
純粋な水 $\text{H}_2\text{O}$ は,わずかに電離して水素イオン $\text{H}^+$ と水酸化物イオン $\text{OH}^-$ を生じています。
$$ \begin{align} \ce{H2O <=> H+ + OH-}\\ \end{align} $$このとき,水素イオン濃度[$\ce{H+}$]と水酸化物イオン濃度[$\ce{OH-}$]の積は一定の値をとります。
その値のことを水のイオン積 $K_w$ といいます。25 ℃ のときは, $K_w = [\ce{H+}][\ce{OH-}] = 1.0 \times 10^{-14}$ (mol/L)$^2$ です。
中性の液体ならば,水素イオンと水酸化物イオンの濃度は等しい([$\ce{H+}$]=[$\ce{OH-}$])ので,水素イオン濃度は次のように求められます。
$$ \begin{align} [\ce{H+}] &= \sqrt{[\ce{H+}][\ce{H+}]} = \sqrt{K_w}\\ &= \sqrt{10^{-14} \, (\text{mol/L})^2}\\ &= 10^{-7} \, \text{mol/L}\\ \end{align} $$こうして中性のpH 7 が得られます。
なお,水のイオン積 $K_w$ は温度によって変化する値で,例えば 0 ℃ の水なら 0.11 $\times$ 10$^{-14}$ (mol/L)$^2$ です。簡単にするために 0.1 $\times$ 10$^{-14}$ (mol/L)$^2$ として,0 ℃ の水のpHを求めてみましょう。
$$ \begin{align} K_w &= 0.1 \times 10^{-14} \, (\text{mol/L})^2 = 10^{-15} \, (\text{mol/L})^2\\ [\ce{H+}] &= \sqrt{K_w} = \sqrt{10^{-15} \, \text{(mol/L)}^2}\\ &= 10^{-7.5} \, \text{mol/L}\\ \end{align} $$0 ℃ の純粋な水の pH は 7.5 となります。
-
pH 0 ってどのくらい?
-

トイレ用の酸性洗剤のpHがおよそ0です。

ラベルには,塩酸(9.5%)とあります。
塩酸は 10% を超えると毒物及び劇物取締法の劇物,薬事法の劇薬に指定され,販売・授与・貯蔵・陳列・消費・輸送等に規制を受けます。
効果と扱いやすさのてんびんで,絶妙な濃度に設定しているようです。
まず,洗剤中の塩酸のモル濃度を求めます。
10% の塩酸の密度は,理科年表2020によると 1.0474 g/cm$^3$ です。この値で近似しましょう。
原子量 H=1,Cl=35 より,HCl の分子量は36なので,モル濃度 $c$ は,次のように求まります。
$$ \begin{align} c &= \frac{ 9.5 \,\text{g} \div 36 \,\text{g/mol}}{100 \,\text{g} \div 1.0474 \,\text{g/cm}^3}\\ &= \frac{ \frac{9.5}{36} \,\text{mol} }{ \frac{100}{1.0474} \,\text{cm}^3}\\ &= \frac{ \frac{9.5}{36} \,\text{mol} }{ \frac{100}{1.0474} \times 10^{-3}\,\text{L}}\\ &= 2.763... \,\text{mol/L}\\ \end{align} $$このとき pH の値は次のようになります。
$$ \begin{align} \text{pH} &= -\log{[\ce{H+}]}\\ &= -\log{2.763}\\ &= -0.441...\\ \end{align} $$pH試験紙とpHテスターで確認しました。



